Quisiera comenzar esta sección, realizando un breve resumen, a modo de introducción, de las diferentes fases de las que se compone el proceso de desarrollo de fármacos y las cuales estudiaremos con detenimiento y en mayor detalle a lo largo de las próximas semanas.
Los medicamentos son, sin duda, una de las sustancias con las que nos encontramos más familiarizados en nuestra vida diaria y que consumimos con mayor o menor asiduidad en función de las condiciones de salud en las que nos encontremos.
Sin embargo, son pocos los que conocen el proceso de fabricación de los mismos y el enorme esfuerzo requerido para que lleguen al mercado y en consecuencia, hasta nuestras manos.
Por todo el mundo existen miles de equipos de investigación analizando enfermedades y tratando de averiguar cuáles son las causas que las originan. Una vez que éstas han sido halladas, las compañías biofarmacéuticas inician el proceso de cómo poder actuar sobre ellas con el objetivo de frenarlas o incluso revertir su avance. Para tal fin, decenas de miles de compuestos son examinados, siendo el origen de los mismos:
▣ Natural: procedentes o bien de sustancias que ya existen en la naturaleza como la morfina, de microorganismos como la penicilina o bien de organismos marinos como la trabectedina con aplicación en procesos cancerosos.
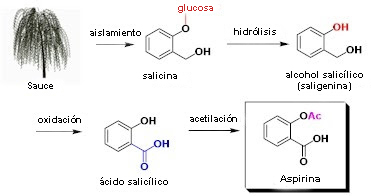
▣ Semisintético: obtenidos en el laboratorio, como el ácido acetilsalicílico producido a partir del ácido salicílico de la corteza del sauce.
▣ Sintético: obtenidos mediante síntesis química completa como es el caso del ibuprofeno.
▣ Biotecnológico: en los que se modifica el material genético de las bacterias de tal manera que produzcan sustancias de interés farmacéutico como anticuerpos o ciertas hormonas humanas (insulina).
Una vez elaborado el compuesto se pasa a la denominada fase preclínica en la que se evalúa la toxicidad y actividad de los mismos tanto en células como en animales de laboratorio mediante un largo y difícil procedimiento de cribado según lo establecido en las buenas prácticas de laboratorio (BPL o GLP en inglés). Posteriormente se seleccionan unos pocos candidatos, se recopila toda la información obtenida sobre ellos con la que la compañía farmacéutica se dirigirá a la agencia reguladora del medicamento (específica en cada país) con la finalidad de poder obtener los permisos para iniciar sus ensayos en seres humanos.
Si los permisos son concedidos, los candidatos se administrarán de acuerdo a las buenas prácticas clínicas (BPC o GCP) en los denominados ensayos clínicos, iniciando de esta manera la fase clínica del proceso. Estos ensayos se dividen en tres fases:
▣ La fase 1 donde se experimenta por primera vez en humanos, se trata de ensayos con un número reducido de voluntarios sanos que se centran en la seguridad del fármaco y su distribución en el organismo.
▣ La fase 2 se lleva a cabo a mayor escala ya con pacientes que presentan la patología para la cual el medicamento ha sido diseñado, focalizándose en la eficacia del mismo y las dosis de administración.
▣ La fase 3 se realiza sobre un gran número de personas, lo que posibilita ampliar el conocimiento adquirido en la fase 2 en una mayor variedad de individuos.
▣ La fase 1 donde se experimenta por primera vez en humanos, se trata de ensayos con un número reducido de voluntarios sanos que se centran en la seguridad del fármaco y su distribución en el organismo.
▣ La fase 2 se lleva a cabo a mayor escala ya con pacientes que presentan la patología para la cual el medicamento ha sido diseñado, focalizándose en la eficacia del mismo y las dosis de administración.
▣ La fase 3 se realiza sobre un gran número de personas, lo que posibilita ampliar el conocimiento adquirido en la fase 2 en una mayor variedad de individuos.
Si el ensayo clínico es exitoso, procedimiento que lleva de 6-7 años, la compañía biofarmacéutica presenta una nueva solicitud a la agencia reguladora conteniendo toda la información obtenida durante los ensayos, que será sometida a una revisión minuciosa, la cual se realizará cuidadosamente durante un largo período de tiempo.
Una vez evaluados todos los datos disponibles, se aprobarán exclusivamente aquellos fármacos que sean seguros y eficaces para su uso público.
Ya autorizado, el medicamento puede pasar a ser fabricado y comercializado, pero a lo largo de su fabricación, al igual que ocurría con las normas de las fases preclínica y clínica (GLP y GCP), la agencia reguladora también somete al fármaco a una serie de requisitos estrictos conocidos como buenas prácticas de fabricación (GMP en inglés).
Aunque el resultado final de todo este proceso pueda llegar a ser algo tan sencillo como tomarse una pastilla un par de veces al día con un vaso de agua, detrás se esconde un extenso y complejo proceso en el que se pueden llegar a ver implicadas cientos de personas, durante un período total de 12-15 años y exigiendo para ello una inversión de 1.000-2.000 millones de dólares.
Fuente: UTAustinX: UT.4.01x Take Your Medicine - The Impact of Drug Development.






Tu opinión es importante
Estás invitado a enviar cualquier comentario o aportación que quieras realizar, gracias.