Las enormes posibilidades que nos ofrece la nanotecnología están permitiendo el avance de nuevos dispositivos en el campo del nanodiagnóstico, principalmente en los nanobiosensores.
Sus propiedades están caracterizadas por la ‘nanoescala’ en la que están fabricados. A diferencia de los biosensores, que estudiamos anteriormente en la entrada "Introducción a los biosensores", donde los receptores se separaban por unos cientos de micrómetros, aquí lo van a estar por unos pocos nanómetros.
Sus propiedades están caracterizadas por la ‘nanoescala’ en la que están fabricados. A diferencia de los biosensores, que estudiamos anteriormente en la entrada "Introducción a los biosensores", donde los receptores se separaban por unos cientos de micrómetros, aquí lo van a estar por unos pocos nanómetros.

Así, incluso se han diseñado sensores en los que se unen a su superficie moléculas individuales, con lo que el proceso de diagnosis puede efectuarse en un instrumento de mucho menor tamaño, facilitando su portabilidad y utilización en cualquier lugar.
También, se requieren cantidades muy pequeñas de muestra (micro o nanolitros) para realizar el análisis, y como consecuencia los métodos de extracción de las mismas van a ser menos traumáticos e invasivos para los pacientes.
También, se requieren cantidades muy pequeñas de muestra (micro o nanolitros) para realizar el análisis, y como consecuencia los métodos de extracción de las mismas van a ser menos traumáticos e invasivos para los pacientes.
Por otro lado, estos nanodispositivos proporcionan la utilización de muestras sin la necesidad de marcadores fluorescentes o radiactivos empleados en los análisis biológicos y clínicos. Esta propiedad es fundamental, ya que se ha verificado que al no marcar ni alterar con anterioridad la muestra, la sensibilidad de detección se incrementa notablemente.
Dentro de los nanobiosensores se distinguen las siguientes categorías:
Dentro de los nanobiosensores se distinguen las siguientes categorías:
Biosensores nanofotónicos
Este tipo de biosensores, también conocidos como de onda evanescente, está basado en el mecanismo a través del cual la luz se transmite mediante múltiples reflexiones internas en la guía óptica que lo compone.
 La luz al propagarse sobre un medio e incidir en otro de menor índice de refracción[1] no se refleja totalmente, con lo que en cada una de estas reflexiones, una componente de la luz (llamada onda evanescente), se propaga en el medio de menor índice que envuelve a la guía. Esta propagación que es extremadamente corta (de apenas unos cientos de nanómetros) en el medio que rodea al núcleo de la guía óptica, posibilita la interacción de la luz con la superficie detectora del sensor, conociendo, de este modo, qué biorreceptores específicos anclados en dicha superficie interactúan con la muestra analizada.
La luz al propagarse sobre un medio e incidir en otro de menor índice de refracción[1] no se refleja totalmente, con lo que en cada una de estas reflexiones, una componente de la luz (llamada onda evanescente), se propaga en el medio de menor índice que envuelve a la guía. Esta propagación que es extremadamente corta (de apenas unos cientos de nanómetros) en el medio que rodea al núcleo de la guía óptica, posibilita la interacción de la luz con la superficie detectora del sensor, conociendo, de este modo, qué biorreceptores específicos anclados en dicha superficie interactúan con la muestra analizada.Mediante estos dispositivos, tan sólo es necesario muestras de unos pocos microlitros para determinar concentraciones de proteínas o variaciones de una única base en el ADN.
También, es posible evaluar el estado metabólico de una única célula al poseer, algunos de estos nanosensores, fibras ópticas muy afiladas (30-50 nm) que pueden introducirse en la membrana celular sin perturbar el funcionamiento normal de la célula y sin ocasionar ningún daño a la misma.
Este método favorece el estudio de las funciones celulares in vivo (apoptosis[2], división celular, nanomáquinas biológicas...) y registra cambios patológicos en una única célula individual.
Este método favorece el estudio de las funciones celulares in vivo (apoptosis[2], división celular, nanomáquinas biológicas...) y registra cambios patológicos en una única célula individual.
Biosensores nanoplasmónicos
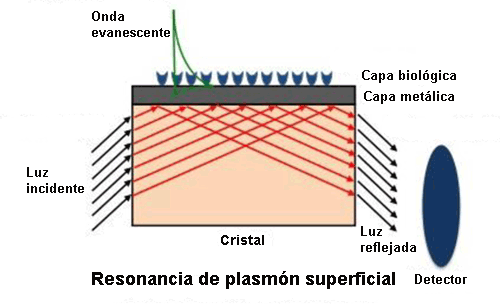
En el sensor de Resonancia de Plasmón Superficial (SPR) se deposita una capa metálica delgada (normalmente una capa de oro de 50 nm de grosor) sobre un material dieléctrico (un cristal).
Su funcionamiento se basa en la detección de cambios en el índice de refracción en las proximidades de la superficie de separación entre ambos elementos.
Al excitar la interfase de estas dos capas (en condiciones de reflexión interna total) se consigue una resonancia plasmónica[3] para un cierto ángulo de incidencia de la luz. Este ángulo al que se produce la onda plasmónica (de carácter evanescente) es muy sensible a los cambios por interacción molecular que se produzcan en la superficie metálica. Por tanto, las interacciones entre el analito[4] de la muestra a analizar y la superficie detectora del sensor se manifestarán como una variación de ese ángulo de resonancia.
Su funcionamiento se basa en la detección de cambios en el índice de refracción en las proximidades de la superficie de separación entre ambos elementos.
Al excitar la interfase de estas dos capas (en condiciones de reflexión interna total) se consigue una resonancia plasmónica[3] para un cierto ángulo de incidencia de la luz. Este ángulo al que se produce la onda plasmónica (de carácter evanescente) es muy sensible a los cambios por interacción molecular que se produzcan en la superficie metálica. Por tanto, las interacciones entre el analito[4] de la muestra a analizar y la superficie detectora del sensor se manifestarán como una variación de ese ángulo de resonancia.
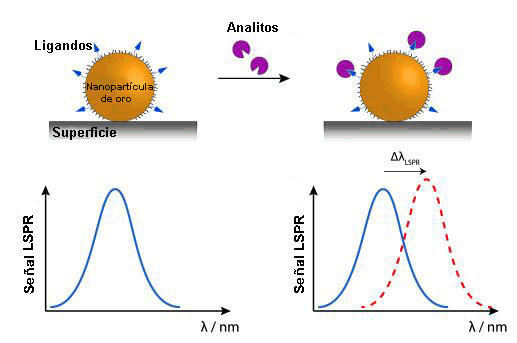
En la actualidad, se están desarrollando biosensores apoyados en el fenómeno de resonancia de plasmón en nanopartículas. Aunque su rango de detección sería muy similar al SPR, su sistema sería más sencillo al medirse transmisión en lugar de reflexión, además de contar con la ventaja de la miniaturización del dispositivo.
Debido al diminuto tamaño de las nanopartículas, la oscilación de los electrones está más localizada que en el caso anterior (en determinadas zonas de las nanopartículas), este hecho se conoce como resonancia de plasmón superficial localizada (LSPR). Y para la detección de la muestra se pueden utilizar los cambios de color (longitud de onda: λ) que se originan en las nanopartículas al adsorber[5] las (bio)moléculas de la muestra examinada.
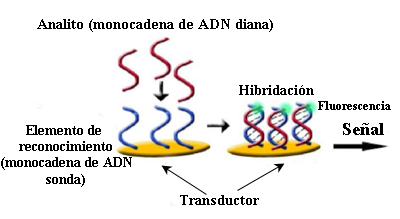
Una alternativa a este fenómeno son los sensores de DNA basados en los cambios de color que se ocasionan al agregarse nanopartículas de oro marcadas con cadenas de DNA complementarias a las que se pretende detectar.
Los biosensores nanoplasmónicos se caracterizan por su posibilidad de detección en tiempo real, alta sensibilidad, especificidad y velocidad de reconocimiento.
Sus aplicaciones más significativas se encuentran en los campos veterinario, biomédico, medioambiental y la industria alimentaria.
Sus aplicaciones más significativas se encuentran en los campos veterinario, biomédico, medioambiental y la industria alimentaria.
Biosensores nanomecánicos
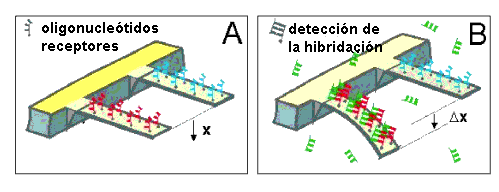
Esta clase de nanobiosensores aprovecha como método de transducción[6] la deflexión o la variación de la frecuencia de resonancia de una micropalanca al interactuar con la muestra estudiada. Por lo tanto, la denominación de estos detectores proviene del movimiento o modificación en la posición de esa micropalanca (Δx), en apenas unos pocos nanómetros, consecuencia de la identificación biomolecular de la muestra analizada.
Puesto que, estas micropalancas pueden producirse en masa a bajo coste mediante tecnología microelectrónica estándar, pueden fabricarse miles de ellas para el diagnóstico simultáneo de miles de analitos en una única muestra.
El área de detección de las micropalancas es en torno a los 1000 μm2, lo que permite testar sustancias en cantidades menores al femtomol (10-15 moles).
Tanto los nanosensores fotónicos como los nanomecánicos podrían ayudarnos a obtener una ilimitada cantidad de información proteómica y genética que posibilitaría el descubrimiento de patógenos, nuevos fármacos, vacunas y mutaciones indicadoras de ciertas enfermedades de manera mucho más rápida que las tecnologías actuales.
Dispositivos microfluídicos o “laboratorio en un chip” (‘lab-on-a-chip’)
En este tipo de instrumentos se utilizan campos eléctricos para desplazar líquidos, partículas, moléculas o células a través de microcapilares construidos en chips de diferentes materiales como silicio, cristal, cuarzo o plástico.
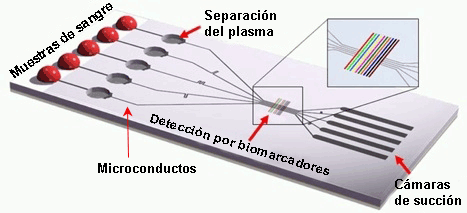 Este tipo de chip está configurado por un número de microconductos y microcámaras integradas donde se llevan a cabo complejas reacciones químicas y bioquímicas de la muestra considerada.
Este tipo de chip está configurado por un número de microconductos y microcámaras integradas donde se llevan a cabo complejas reacciones químicas y bioquímicas de la muestra considerada.El volumen de fluidos y de muestra requerido es muy pequeño, con lo que el análisis se realiza con gran rapidez. Se trata de un método de detección portátil, desechable y con un alto grado de automatización.
La idea final de todos estos avances es el desarrollo de nanodispositivos biocompatibles, que puedan ser implantados in vivo en nuestro organismo, en el que desempeñarían una función similar a centinelas que avisasen ante las primeras células enfermas.
Ya se han conseguido algunos avances a tales efectos a nivel micro (píldoras con cámaras de vídeo), pero, indudablemente, éste será uno de los grandes campos de investigación de la nanomedicina en los próximos años.
Ya se han conseguido algunos avances a tales efectos a nivel micro (píldoras con cámaras de vídeo), pero, indudablemente, éste será uno de los grandes campos de investigación de la nanomedicina en los próximos años.
[1] Cociente de la velocidad de la luz en el vacío (c) y la velocidad de la luz en un medio determinado (v), n = c / v.
[2] Destrucción o muerte celular programada provocada por la misma célula.
[3] Excitación u oscilación de electrones que se produce en la interfase de dos materiales, en nuestro caso una película metálica sobre un substrato dieléctrico.
[4] Sustancia (ión, compuesto o elemento) que deseamos analizar en una muestra.
[5] Atraer y retener en la superficie de una sustancia iones o moléculas de otra.
[6] Transformación de un tipo de señal o energía en otra de distinta naturaleza.
[2] Destrucción o muerte celular programada provocada por la misma célula.
[3] Excitación u oscilación de electrones que se produce en la interfase de dos materiales, en nuestro caso una película metálica sobre un substrato dieléctrico.
[4] Sustancia (ión, compuesto o elemento) que deseamos analizar en una muestra.
[5] Atraer y retener en la superficie de una sustancia iones o moléculas de otra.
[6] Transformación de un tipo de señal o energía en otra de distinta naturaleza.
Fuentes: Nanomedicina: aplicación de la nanotecnología en la salud. Laura M. Lechuga. Grupo de Nanobiosensores y Aplicaciones Bioanalíticas
Centro de Investigación en Nanociencia y Nanotecnología (CIN2). CSIC
http://www.kennislink.nl/publicaties/de-opmars-van-de-twentse-lab-on-a-chip
http://images.slideplayer.es/16/5040279/slides/slide_47.jpg
http://www.mdpi.com/sensors/sensors-10-09630/article_deploy/html/images/sensors-10-09630f1-1024.png
https://www.ifm.liu.se/applphys/molphys/research/biosensing_using_nanopart/
http://www.tcd.ie/Physics/people/Martin.Hegner/ReviewNSST-The_impact_of_STM_and_AFM.html?ntherodt_01.pdf
Fritz, J., Baller, M.K., Lang, H.P., Rothuizen, H., Vettiger, P., Meyer, E., Guntherodt, H.-J., Gerber, CH. and Gimzewski, J.K.,
Science 288 (2000) 316.
https://www.theengineer.co.uk/lab-on-chip-device-promises-hiv-diagnosis-in-10-minutes/
Centro de Investigación en Nanociencia y Nanotecnología (CIN2). CSIC
http://www.kennislink.nl/publicaties/de-opmars-van-de-twentse-lab-on-a-chip
http://images.slideplayer.es/16/5040279/slides/slide_47.jpg
http://www.mdpi.com/sensors/sensors-10-09630/article_deploy/html/images/sensors-10-09630f1-1024.png
https://www.ifm.liu.se/applphys/molphys/research/biosensing_using_nanopart/
http://www.tcd.ie/Physics/people/Martin.Hegner/ReviewNSST-The_impact_of_STM_and_AFM.html?ntherodt_01.pdf
Fritz, J., Baller, M.K., Lang, H.P., Rothuizen, H., Vettiger, P., Meyer, E., Guntherodt, H.-J., Gerber, CH. and Gimzewski, J.K.,
Science 288 (2000) 316.
https://www.theengineer.co.uk/lab-on-chip-device-promises-hiv-diagnosis-in-10-minutes/





















Tu opinión es importante
Estás invitado a enviar cualquier comentario o aportación que quieras realizar, gracias.