El enlace químico se define como aquella fuerza que une o enlaza a dos o más átomos del mismo o distinto elemento con la finalidad de constituir estructuras con un nivel superior de complejidad: las moléculas. Entre los enlaces más importantes que van a posibilitar la formación de macromoléculas biológicas, que estudiaremos con detalle posteriormente, se encuentran:
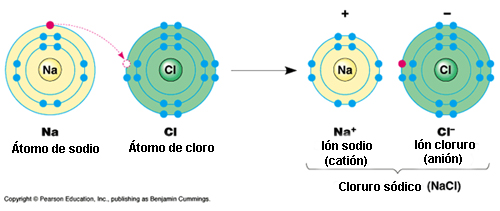
▣ Enlaces iónicos: formados entre iones con cargas opuestas. Un ejemplo clásico de este tipo de enlace lo constituye el cloruro sódico (NaCl), más comunmente conocido como sal de mesa. Esta molécula se forma por la ionización[1] de los átomos de sodio (Na) y cloro (Cl), y la atracción de los iones resultantes.
▣ Enlaces covalentes: consisten en la compartición de electrones entre átomos para formar el enlace y satisfacer la regla del octeto[2]. Los enlaces covalentes, a su vez, pueden dividirse en dos tipos:
1. Enlaces covalentes polares: los electrones se encuentran desigualmente compartidos por los átomos (presentan distinta electronegatividad), de tal manera, que son más atraídos por uno de los núcleos que por el otro, con lo que una parte de la molécula se encuentra con una carga ligeramente positiva (δ+) y la otra, en cambio, ligeramente negativa (δ-). Un ejemplo sería la molécula de agua, en la que los dos átomos de hidrógeno poseen una leve carga positiva y el oxígeno una leve carga negativa.
2. Enlaces covalentes no polares: formados por dos átomos del mismo o diferente elemento los cuales comparten los electrones equitativamente. En el oxígeno molecular (O2), por ejemplo, los electrones se distribuyen de manera igualitaria entre los dos átomos.
▣ Puentes de hidrógeno: interacciones débiles producidas entre el hidrógeno cargado positivamente y otros átomos (habitualmente nitrógeno y oxígeno) ligeramente negativos. Este tipo de enlace puede surgir entre distintas moléculas o dentro de la misma. Una de sus funciones más importantes es la unión de las dos hebras que constituyen la doble hélice de la molécula de ADN.
▣ Fuerzas de Van der Waals: atracciones débiles entre moléculas debidas al movimiento de electrones que producen, a su vez, ligeras fluctuaciones en las densidades electrónicas[3] de estas moléculas, generándose así polos cargados positiva y negativamente. Contribuyen junto a los enlaces iónicos, covalentes y puentes de hidrógeno a la estructura tridimensional de las proteínas.
[1] Fenómeno por el que se producen iones.
[2] Establece que la gran mayoría de los átomos son más estables energéticamente cuando tienen ocho electrones en su capa electrónica más externa, también conocida como capa de valencia.
[3] Probabilidad de encontrar un electrón en una cierta región del átomo
[2] Establece que la gran mayoría de los átomos son más estables energéticamente cuando tienen ocho electrones en su capa electrónica más externa, también conocida como capa de valencia.
[3] Probabilidad de encontrar un electrón en una cierta región del átomo
Fuente: OpenStax College, Biology. OpenStax College. 30 May 2013.







Tu opinión es importante
Estás invitado a enviar cualquier comentario o aportación que quieras realizar, gracias.