Según la normativa española y europea todos los ensayos clínicos deben realizarse de acuerdo con las normas de buenas prácticas clínicas (BPC) que constituyen una garantía para la protección del paciente y para los resultados de los ensayos.
Las normas de BPC de la Conferencia Internacional de Harmonización (ICH)[1] son exigidas por las autoridades europeas desde 1996 y también han sido adoptadas por EEUU y Japón. Son un conjunto de requisitos de calidad científicos y éticos reconocidos a escala internacional que deben cumplirse en la planificación, realización, registro y comunicación de los ensayos clínicos donde participan seres humanos.
Estas normas deben asegurar los derechos, seguridad y bienestar de los sujetos del ensayo y la fiabilidad de los resultados.
Estas normas deben asegurar los derechos, seguridad y bienestar de los sujetos del ensayo y la fiabilidad de los resultados.
Las BPC surgen de la necesidad de conciliar los intereses del sujeto que recibe el tratamiento y el interés de la sociedad en aumentar el conocimiento sobre los medicamentos.
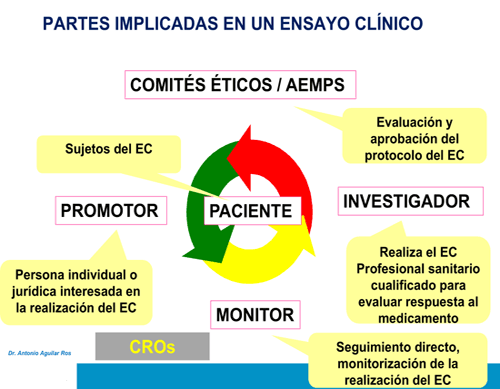
Las partes implicadas en un ensayo clínico son las siguientes:
▣ Promotor: persona jurídica o física interesada en realizar un ensayo clínico y responsable del mismo. Normalmente se trata de una multinacional farmacéutica.
▣ Comités éticos: pertenecen al centro donde se realiza la investigación.
▣ Agencias reguladoras: pertenecen a la Administración.
Estos dos últimos deben aprobar el protocolo y supervisar el desarrollo del ensayo. Las agencias además evalúan los resultados de la investigación para autorizar la posterior comercialización del medicamento.
Estos dos últimos deben aprobar el protocolo y supervisar el desarrollo del ensayo. Las agencias además evalúan los resultados de la investigación para autorizar la posterior comercialización del medicamento.
▣ Investigador: realiza o dirige la investigación del ensayo, suele ser un médico o personal sanitario que evalúa la respuesta del compuesto objeto de estudio.
▣ Monitor: responsable del seguimiento directo de la realización del ensayo. Intermediario entre el promotor y el investigador, debe garantizar la trazabilidad de todo lo acontecido en el ensayo.
▣ Paciente: sujeto participante en la investigación que generalmente padece la enfermedad de interés.
En ocasiones, la gestión y monitorización del ensayo la proporcionan unas empresas denominadas CROs (compañías de investigación por contrato).Tras la II Guerra Mundial se promulgó el Código de Nuremberg en el que se establecen los principios de investigación clínica en seres humanos y que son:
▣ Autonomía: principio de respeto a los sujetos, tratados como personas autónomas con libre capacidad para decidir si quieren participar en el ensayo clínico.
El consentimiento informado (CI)[2] firmado por el paciente forma parte del cumplimiento de este principio.
El consentimiento informado (CI)[2] firmado por el paciente forma parte del cumplimiento de este principio.
▣ Beneficencia: el médico está obligado a hacer el bien y el bienestar del paciente, así como su máximo beneficio.
▣ No maleficencia: evitar pruebas clínicas perjudiciales para el paciente.
▣ Justicia: los resultados obtenidos deben revertir en las personas que sufran las cargas del ensayo. Por ejemplo, este principio no se cumpliría si un país del tercer mundo, donde se realiza un ensayo, no se beneficiase del tratamiento por el alto coste del mismo.
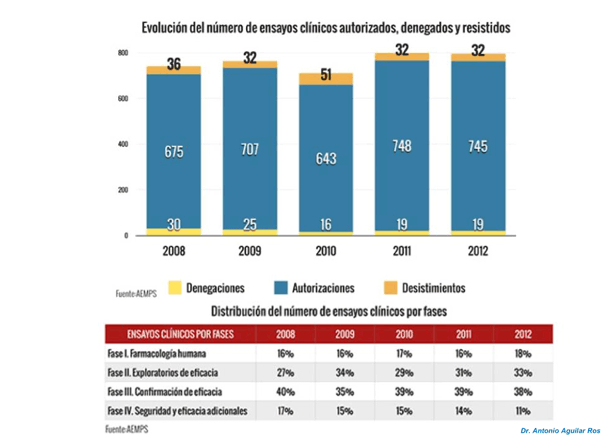
Fase IV de la investigación clínica
Una vez comercializado el fármaco, se continúa investigando para seguir aumentando el conocimiento acerca de su seguridad y efectividad, identificar nuevos riesgos y reacciones adversas no detectadas en investigaciones previas.
El conjunto de estudios y ensayos controlados y aleatorizados que se llevan a cabo en este punto se denomina fase IV del ensayo clínico.
El conjunto de estudios y ensayos controlados y aleatorizados que se llevan a cabo en este punto se denomina fase IV del ensayo clínico.
Los estudios epidemiológicos (observacionales) más frecuentes tras la autorización del fármaco son los de casos y controles y los de cohortes.
Finalmente, existe el programa de notificación de reacciones adversas a medicamentos (RAM), mediante las denominadas tarjetas amarillas, obligatorio para los profesionales médicos y que actualmente también pueden ser cumplimentadas por los pacientes. Estas tarjetas se emplean especialmente cuando el medicamento ha sido recientemente comercializado.
Constan de varios apartados entre los que se encuentran los datos personales del paciente (nombre o iniciales, edad, sexo, peso, altura...), datos de la medicación sospechosa de la reacción adversa, descripción de esa reacción, observaciones adicionales y los datos del notificador (nombre, profesión, centro de trabajo...).
Constan de varios apartados entre los que se encuentran los datos personales del paciente (nombre o iniciales, edad, sexo, peso, altura...), datos de la medicación sospechosa de la reacción adversa, descripción de esa reacción, observaciones adicionales y los datos del notificador (nombre, profesión, centro de trabajo...).
[1] Armoniza los distintos requerimientos regionales para el registro de productos farmacéuticos.
[2] El sujeto participante en el ensayo es informado a través de este documento en un lenguaje asequible de los pormenores del ensayo, sus ventajas e inconvenientes, pudiendo abandonarlo libremente en cualquier momento.
[2] El sujeto participante en el ensayo es informado a través de este documento en un lenguaje asequible de los pormenores del ensayo, sus ventajas e inconvenientes, pudiendo abandonarlo libremente en cualquier momento.
Fuentes: CEU Universidad San Pablo: Farmacología Básica, 2013.
http://www.ub.edu/sdm/tertulies/armonizacion_y_ich.pdf
http://www.ich.org/home.html
http://www.ub.edu/sdm/tertulies/armonizacion_y_ich.pdf
http://www.ich.org/home.html






Tu opinión es importante
Estás invitado a enviar cualquier comentario o aportación que quieras realizar, gracias.