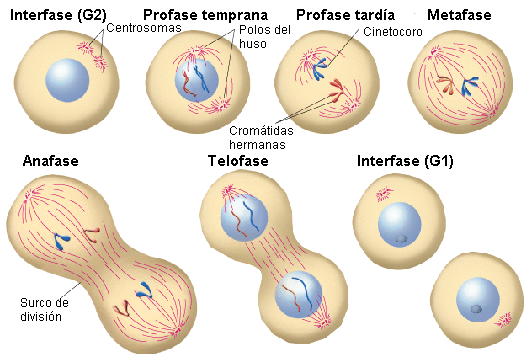
El ciclo celular es un conjunto de sucesos ordenados que involucran el crecimiento y la división celular para producir dos células hijas nuevas.
Las células en su camino hacia la división celular atraviesan una serie de etapas de crecimiento, replicación del DNA y división, cuidadosamente reguladas y sincronizadas con precisión con el fin de producir dos células idénticas.
Dos fases principales componen el ciclo celular: la interfase y la fase mitótica. Durante la primera, la célula crece y se replica el DNA. Mientras, en la fase mitótica, el DNA replicado y el contenido citoplasmático se separan y la célula se divide.
Interfase
La interfase es el período más largo del ciclo celular, transcurre entre dos mitosis y en ella se distinguen las siguientes fases:
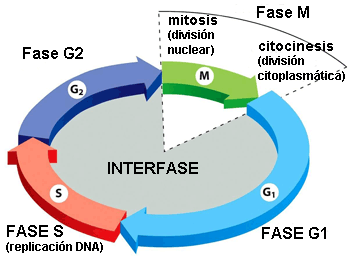
▣ G1: la célula crece hasta alcanzar su tamaño crítico. Se sintetizan RNA y proteínas y se duplica el centrosoma. Si las condiciones son adecuadas, la célula sobrepasa el denominado punto de restricción (punto de control de la fase G1) y continúa a la siguiente fase.
Las células diferenciadas que no se dividen (p. ej., neuronas o células del músculo cardíaco) abandonan el ciclo celular en esta etapa y comienzan la fase G0[1].
Las células diferenciadas que no se dividen (p. ej., neuronas o células del músculo cardíaco) abandonan el ciclo celular en esta etapa y comienzan la fase G0[1].
▣ S: se replica el DNA. De este modo, las dos células hijas heredarán el mismo genoma de la célula madre.
▣ G2: fase de reparación del DNA y preparación para la mitosis. La célula duplica su tamaño respecto a G1.
Fase mitótica
La fase mitótica es un proceso de múltiples pasos durante el cual los cromosomas duplicados se alinean, se separan y se trasladan a las dos nuevas células hijas generadas.
La primera parte de la fase mitótica se denomina cariocinesis, mitosis o división del núcleo y la segunda parte citocinesis, que consiste en la separación física de los componentes citoplasmáticos en las dos células hijas.
En la mitosis se produce el reparto equitativo del material genético, que consta, a su vez, de las siguientes etapas:La primera parte de la fase mitótica se denomina cariocinesis, mitosis o división del núcleo y la segunda parte citocinesis, que consiste en la separación física de los componentes citoplasmáticos en las dos células hijas.
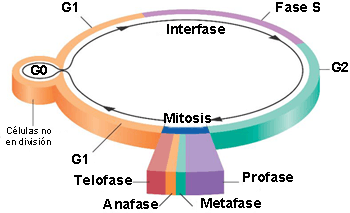
▣ Profase: la cromatina se condensa, se forma el huso mitótico[2] y el nucleolo desaparece.
▣ Prometafase: se origina la desintegración de la envoltura nuclear. Los cromosomas se unen a los microtúbulos gracias a los cinetocoros[3].
▣ Metafase: los cromosomas se alinean aleatoriamente en un plano denominado placa metafásica, o plano ecuatorial, a mitad de camino entre los dos polos de la célula.
▣ Anafase: se produce el acortamiento de los microtúbulos del huso que da lugar a la separación de las cromátidas hermanas.
▣ Telofase: los cromosomas se descondensan y se organiza la envoltura nuclear. Se forma el nucleolo y desaparece el huso mitótico.
En la etapa final de la fase mitótica, la citocinesis, se forma un anillo contráctil de filamentos de actina que divide el citoplasma entre las dos células hijas.
Control del ciclo celular
La duración del ciclo celular es altamente variable, incluso en las células de un mismo organismo. En los humanos varía desde unas pocas horas de las células embrionarias a una media de 2 a 5 días para las células epiteliales o el período de una vida humana completa para las células especializadas, como las células musculares cardíacas o las neuronas corticales.
También existe variación en el tiempo en el que una célula transcurre en cada fase del ciclo. Así, por ejemplo, las células humanas con un ciclo de 24 horas, pasan aproximadamente nueve horas en la fase G1, diez horas en la fase S, alrededor de cuatro horas y media en la fase G2 y aproximadamente treinta minutos en la fase M.
La regulación del tiempo en cada uno de los pasos del ciclo celular es controlada por mecanismos tanto internos como externos a la célula.
Regulación a través de eventos externos
Tanto el comienzo como la finalización del ciclo celular son activados por eventos externos a la célula cuando está a punto de comenzar el proceso de replicación.
Por ejemplo, sucesos como la muerte de una célula cercana, la liberación de hormonas promotoras del crecimiento o que la célula alcance un determinado tamaño pueden iniciar la división celular.
Independientemente del tipo de mensaje recibido, la célula recibe la señal y una serie de acontecimientos en su interior la dirigen hacia la interfase.
Partiendo de este punto inicial, debe satisfacerse cada parámetro requerido en cada fase para que el ciclo celular pueda seguir adelante.
Por ejemplo, sucesos como la muerte de una célula cercana, la liberación de hormonas promotoras del crecimiento o que la célula alcance un determinado tamaño pueden iniciar la división celular.
Independientemente del tipo de mensaje recibido, la célula recibe la señal y una serie de acontecimientos en su interior la dirigen hacia la interfase.
Partiendo de este punto inicial, debe satisfacerse cada parámetro requerido en cada fase para que el ciclo celular pueda seguir adelante.
Regulación a través de puntos de control internos
Los puntos de control del ciclo celular van a evitar que las células con errores en la duplicación o en la distribución de los cromosomas y que, por lo tanto, produzcan mutaciones, puedan continuar progresando hasta que sean solventados.
Se distinguen tres puntos de control:
▣ Punto de control G1: también denominado punto de restricción en mamíferos. Actúa cerca del final de la fase G1 y determina si se dan todos los requisitos necesarios para proceder a la división celular.
 Si no se cumplen, la célula puede parar el ciclo hasta que las condiciones adversas se solucionen o puede pasar a la fase G0 y esperar señales que indiquen que las condiciones han mejorado.
Si no se cumplen, la célula puede parar el ciclo hasta que las condiciones adversas se solucionen o puede pasar a la fase G0 y esperar señales que indiquen que las condiciones han mejorado.
 Si no se cumplen, la célula puede parar el ciclo hasta que las condiciones adversas se solucionen o puede pasar a la fase G0 y esperar señales que indiquen que las condiciones han mejorado.
Si no se cumplen, la célula puede parar el ciclo hasta que las condiciones adversas se solucionen o puede pasar a la fase G0 y esperar señales que indiquen que las condiciones han mejorado.▣ Punto de control G2: realiza su acción durante la transición de las etapas G2/M. Su misión más importante es asegurar que todos los cromosomas han sido replicados y esa replicación se ha producido sin daños en el DNA. Si se detectasen daños, el ciclo se para, y la célula intenta completar la replicación del DNA o repara el que está dañado.
▣ Punto de control M: también conocido como punto de control del ensamblaje del huso. Tiene lugar cerca del final de la etapa de la cariocinesis.
Determina si las cromátidas hermanas están correcta y firmemente unidas a los microtúbulos mediante los cinetocoros.
Determina si las cromátidas hermanas están correcta y firmemente unidas a los microtúbulos mediante los cinetocoros.
El sistema de control del ciclo celular podría asemejarse al sistema programador de una lavadora, donde la lavadora solamente prosigue con el lavado si las señales que recibe de sus sensores (puerta cerrada, niveles de agua y detergente, suministro eléctrico) son las adecuadas para continuar durante las distintas etapas del ciclo de lavado.
Moléculas reguladoras del ciclo
Además de los puntos de control, existen unas moléculas intracelulares que regulan el ciclo celular y que pueden actuar de manera individual o influyen en la actividad o en la producción de otras proteínas reguladoras.
Se distinguen dos grupos: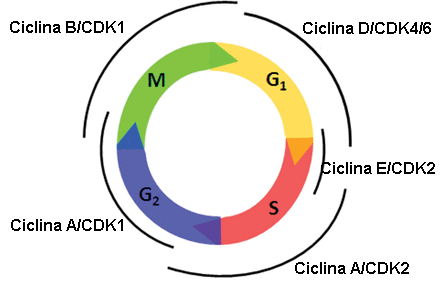
▣ Aquellas moléculas que promueven el progreso de la célula a la siguiente fase (regulación positiva). A su vez, se clasifican en dos tipos de proteínas: ciclinas[4] y quinasas dependientes de ciclinas (CDKs)[5].
▣ El segundo grupo de moléculas reguladoras son los reguladores negativos que se encargan de parar el ciclo celular. Las mejores conocidas de todas ellas son las proteínas del retinoblastoma (Rb), p53 y p21.
La proteína del retinoblastoma es una proteína supresora de tumores que se encuentra alterada en muchos tipos de cáncer (próstata, mama), pero es del cáncer de retina de donde toma su nombre.
La proteína p21 inhibe el ciclo celular, estando sus niveles controlados, a su vez, por la proteína p53 que regula el crecimiento celular y controla los daños en el DNA, parando el ciclo en su caso, pudiendo inducir apoptosis.
La proteína del retinoblastoma es una proteína supresora de tumores que se encuentra alterada en muchos tipos de cáncer (próstata, mama), pero es del cáncer de retina de donde toma su nombre.
La proteína p21 inhibe el ciclo celular, estando sus niveles controlados, a su vez, por la proteína p53 que regula el crecimiento celular y controla los daños en el DNA, parando el ciclo en su caso, pudiendo inducir apoptosis.
[1] Fase de quiescencia (inactividad) permanente o temporal en la que se detiene el ciclo celular.
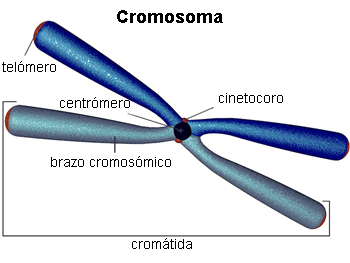
[2] Conjunto de microtúbulos cuya función es posibilitar la migración y correcta separación de los cromosomas durante la mitosis.
[3] Estructuras proteicas cuya función es iniciar, controlar y supervisar los movimientos de los cromosomas durante la división celular.
[4] Proteínas sintetizadas en la interfase y destruidas al final de la mitosis en cada ciclo. Regulan la actividad enzimática de las CDKs.
[5] Enzimas que activan o inactivan otras proteínas fosforilándolas (añadiéndoles grupos fosfatos).
[2] Conjunto de microtúbulos cuya función es posibilitar la migración y correcta separación de los cromosomas durante la mitosis.
[3] Estructuras proteicas cuya función es iniciar, controlar y supervisar los movimientos de los cromosomas durante la división celular.
[4] Proteínas sintetizadas en la interfase y destruidas al final de la mitosis en cada ciclo. Regulan la actividad enzimática de las CDKs.
[5] Enzimas que activan o inactivan otras proteínas fosforilándolas (añadiéndoles grupos fosfatos).
Fuentes: OpenStax College, Biology. OpenStax College. 30 May 2013.
http://www.biocancer.com/journal/1219/41-regulacion-positiva-del-ciclo-celular
http://www.pucmmsti.edu.do/websise/estudiante/materias/201120122/ST-BIO-112-T-003/04.%20Regulacion%20del%20ciclo%
20celular%20Apoptosis%20Cancer%20%20.pdf
http://bio3400.nicerweb.com/Locked/media/ch02/interphase.html
http://www.slideshare.net/obessionforu/cell-cycle-and-molecular-basis-of-cancer
http://biologicalexceptions.blogspot.com.es/2013_01_01_archive.html
http://gleesonbiology.pbworks.com/w/page/7537859/C9
http://www.bioscirep.org/content/30/4/243
http://www.biocancer.com/journal/1219/41-regulacion-positiva-del-ciclo-celular
http://www.pucmmsti.edu.do/websise/estudiante/materias/201120122/ST-BIO-112-T-003/04.%20Regulacion%20del%20ciclo%
20celular%20Apoptosis%20Cancer%20%20.pdf
http://bio3400.nicerweb.com/Locked/media/ch02/interphase.html
http://www.slideshare.net/obessionforu/cell-cycle-and-molecular-basis-of-cancer
http://biologicalexceptions.blogspot.com.es/2013_01_01_archive.html
http://gleesonbiology.pbworks.com/w/page/7537859/C9
http://www.bioscirep.org/content/30/4/243
Leer más