Las proteínas, sin duda, son las macromoléculas biológicas con mayor variedad en estructura y funciones. Hallamos miles en una sola célula, desempeñando cada una de ellas un papel específico y único.
De esta manera, vamos a encontrar proteínas realizando actividades de transporte o almacenaje, proteínas protectoras, contráctiles, estructurales, enzimas o toxinas. Teniendo todas ellas en común polímeros de aminoácidos que se ordenan mediante cadenas lineales y actúan como elemento básico estructural.
De esta manera, vamos a encontrar proteínas realizando actividades de transporte o almacenaje, proteínas protectoras, contráctiles, estructurales, enzimas o toxinas. Teniendo todas ellas en común polímeros de aminoácidos que se ordenan mediante cadenas lineales y actúan como elemento básico estructural.
Tipos y funciones de proteínas
▣ Enzimas: son conocidas como proteínas complejas o conjugadas, cuya labor primordial es intervenir en reacciones bioquímicas como catalizadores orgánicos, en las cuales van a ayudar a sintetizar, reordenar o descomponer los distintos elementos sobre los que actúan de manera específica.
Un ejemplo serían las enzimas digestivas como la amilasa de la saliva que hidroliza la amilosa (componente del almidón).
Un ejemplo serían las enzimas digestivas como la amilasa de la saliva que hidroliza la amilosa (componente del almidón).
▣ Hormonas: controlan y regulan procesos fisiológicos como el metabolismo, el crecimiento o la reproducción. Liberadas por las células endocrinas, se tratan de moléculas de señalización química, normalmente pequeñas proteínas o esteroides.
Como ejemplo de proteína hormonal podemos citar la insulina, que se encarga de regular los niveles de glucosa en sangre.
Como ejemplo de proteína hormonal podemos citar la insulina, que se encarga de regular los niveles de glucosa en sangre.
Las proteínas presentan una amplia variedad de pesos moleculares y formas, desempeñando éstas últimas un papel primordial en las actividades que vayan a realizar. Mediante la exposición a agentes químicos, cambios en el pH o la temperatura se originan variaciones en la forma de la proteína, que conducen a la pérdida de sus funciones en un proceso denominado desnaturalización.
Aminoácidos
Los aminoácidos son los monómeros que constituyen las proteínas. Cada uno de ellos tiene una estructura formada por un átomo central de carbono, conocido como carbono α, al que se le une un grupo amino (NH2), un grupo carboxilo (COOH) y un átomo de hidrógeno. Precisamente, la denominación de ‘aminoácido’ procede de la presencia de estos dos grupos en la estructura básica del mismo.
Cada aminoácido también posee otro átomo o grupo de átomos unidos al átomo central, denominado grupo R o cadena lateral que es propio para cada uno de ellos. La naturaleza química de esta cadena establece el tipo de aminoácido (si es polar, no polar, básico, ácido...). Así, encontramos aminoácidos básicos como la arginina y la lisina, al poseer carga positiva. Otros como la cisteína o la serina son polares con una cadena lateral hidrofílica o si ésta es de naturaleza hidrofóbica son no polares como la alanina o la valina.
De los veinte tipos de aminoácidos distintos de los cuales se componen las proteínas, diez de ellos son considerados esenciales, ya que son los bloques necesarios para la construcción de las mismas, pero el cuerpo humano no puede sintetizarlos y deben obtenerse de la dieta.
El sistema de representación de los aminoácidos se lleva a cabo mediante una letra mayúscula o una combinación de tres de ellas. Por ejemplo, la cisteína se simboliza mediante la letra C o Cys en código de tres letras.
La secuencia y el número de aminoácidos es quien establece en última instancia el tamaño, la función y la forma de la proteína.
Los aminoácidos se unen mediante un enlace de tipo covalente, conocido como enlace peptídico, en el que el grupo carboxilo de un aminoácido se enlaza al grupo amino del aminoácido contiguo, liberando una molécula de agua (reacción de deshidratación).
Los productos de estos enlaces se denominan péptidos y su unión da lugar a una cadena de polipéptidos. Cada uno de ellos cuenta con un grupo amino libre al final de la cadena, denominado terminal N o terminal amino, teniendo en el otro extremo un grupo carboxilo conocido como terminal C o terminal carboxilo.
Los productos de estos enlaces se denominan péptidos y su unión da lugar a una cadena de polipéptidos. Cada uno de ellos cuenta con un grupo amino libre al final de la cadena, denominado terminal N o terminal amino, teniendo en el otro extremo un grupo carboxilo conocido como terminal C o terminal carboxilo.
En ocasiones, los términos polipéptido y proteína se emplean indistintamente, pero técnicamente un polipéptido es un polímero de aminoácidos, mientras que una proteína es un polipéptido o polipéptidos que se han combinado con una forma y función característica y particular.
Estructura de las proteínas
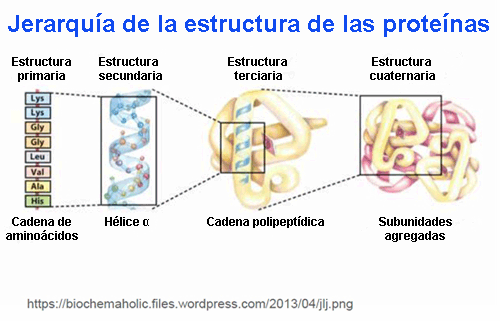
Como ya se ha mencionado, la forma que adopta la proteína es fundamental para las funciones que desempeña. Con el fin de entender cómo la proteína toma su forma o conformación final es necesario estudiar los cuatro niveles estructurales en los que se organiza: primario, secundario, terciario y cuaternario.
Estructura primaria
La estructura primaria se define como la secuencia única de aminoácidos en una cadena de polipéptidos. Por ejemplo, la hormona insulina tiene dos cadenas polipeptídicas A y B, formadas por unas secuencias únicas de 21 y 30 aminoácidos respectivamente y unidas entre ellas por dos enlaces disulfuro entre los aminoácidos cisteína. Un tercer enlace disulfuro en la cadena A, también entre dos aminoácidos cisteína, posibilita que se pliegue de la manera adecuada.
La secuencia única de cada proteína viene determinada finalmente por el gen que la codifica, y cualquier alteración en la cadena de nucleótidos[1] que compone el gen puede originar aminoácidos distintos que se serán añadidos, posteriormente, en la cadena polipeptídica, afectando la estructura y rol de la proteína resultante.
Así, un único cambio en uno de los 600 aminoácidos que componen la proteína hemoglobina provoca tal variación en su estructura y actividad que produce la aparición de la anemia de células falciformes[2]. Concretamente, en la cadena β de esta proteína el ácido glutámico es sustituido por el aminoácido valina.
Para ser más exactos, como cada aminoácido se compone de tres bases nucleótidas, esos 600 aminoácidos dan lugar a 1.800 bases y la hemoglobina falciforme, causante de la anemia, surge por un único cambio en esas 1.800 bases.
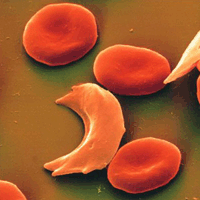
A raíz de esta modificación, las moléculas de hemoglobina forman largas fibras que distorsionan la forma bicóncava o forma de disco de los glóbulos rojos, adquiriendo una forma de hoz o media luna que tapona las arterias, desencadenando una serie de trastornos tan característicos de la anemia como son los dolores de cabeza y abdominales, la dificultad respiratoria o los mareos.
Para ser más exactos, como cada aminoácido se compone de tres bases nucleótidas, esos 600 aminoácidos dan lugar a 1.800 bases y la hemoglobina falciforme, causante de la anemia, surge por un único cambio en esas 1.800 bases.

A raíz de esta modificación, las moléculas de hemoglobina forman largas fibras que distorsionan la forma bicóncava o forma de disco de los glóbulos rojos, adquiriendo una forma de hoz o media luna que tapona las arterias, desencadenando una serie de trastornos tan característicos de la anemia como son los dolores de cabeza y abdominales, la dificultad respiratoria o los mareos.
Estructura secundaria
Estas estructuras se forman por el plegamiento local del polipéptido en ciertas regiones, las más comunes son las hélices α y las láminas β u hoja plegada β.
 En las hélices α la estructura primaria se enrolla helicoidalmente sobre sí misma, habiendo 3,6 aminoácidos en cada vuelta. Se constituyen mediante enlaces de hidrógeno entre el grupo carbonilo (C=O) de un aminoácido y el grupo amino (N-H) de un aminoácido situado cuatro posiciones más alejado en la cadena polipeptídica.
En las hélices α la estructura primaria se enrolla helicoidalmente sobre sí misma, habiendo 3,6 aminoácidos en cada vuelta. Se constituyen mediante enlaces de hidrógeno entre el grupo carbonilo (C=O) de un aminoácido y el grupo amino (N-H) de un aminoácido situado cuatro posiciones más alejado en la cadena polipeptídica.
 En las hélices α la estructura primaria se enrolla helicoidalmente sobre sí misma, habiendo 3,6 aminoácidos en cada vuelta. Se constituyen mediante enlaces de hidrógeno entre el grupo carbonilo (C=O) de un aminoácido y el grupo amino (N-H) de un aminoácido situado cuatro posiciones más alejado en la cadena polipeptídica.
En las hélices α la estructura primaria se enrolla helicoidalmente sobre sí misma, habiendo 3,6 aminoácidos en cada vuelta. Se constituyen mediante enlaces de hidrógeno entre el grupo carbonilo (C=O) de un aminoácido y el grupo amino (N-H) de un aminoácido situado cuatro posiciones más alejado en la cadena polipeptídica.En la conformación beta los aminoácidos se disponen en forma de zigzag, en una disposición de lámina plegada. También tiene su origen en los puentes de hidrógeno originados entre los grupos N-H y C=O, pero en esta ocasión pertenecientes a cadenas adyacentes.
Estructura terciaria
Esta configuración indica cómo la estructura secundaria de un polipéptido se pliega sobre sí misma dando lugar a una conformación globular.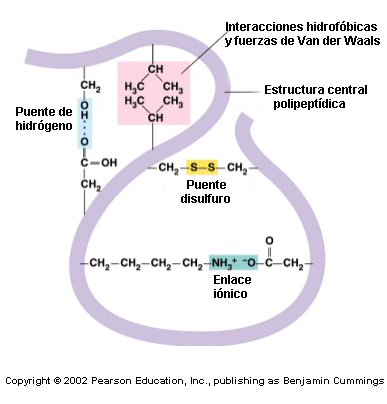
Es la configuración que determina las propiedades fisicoquímicas de la proteína y favorece su solubilidad en agua, posibilitándola, de este modo, llevar a cabo funciones hormonales enzimáticas y de transporte.
Esta estructura se mantiene estable gracias a la existencia de enlaces entre los radicales o grupos R de los aminoácidos, los cuales se generan a través de los siguientes tipos de interacciones: puentes disulfuro[3], puentes de hidrógeno, interacciones iónicas, hidrofóbicas y fuerzas de Van der Waals (para refrescar todos estos conceptos visita la entrada: “Enlaces químicos”).
Generalmente, en esta disposición los aminoácidos apolares se sitúan hacia el interior de la proteína y los polares hacia el exterior, interactuando con el ambiente acuoso circundante.

Es la configuración que determina las propiedades fisicoquímicas de la proteína y favorece su solubilidad en agua, posibilitándola, de este modo, llevar a cabo funciones hormonales enzimáticas y de transporte.
Esta estructura se mantiene estable gracias a la existencia de enlaces entre los radicales o grupos R de los aminoácidos, los cuales se generan a través de los siguientes tipos de interacciones: puentes disulfuro[3], puentes de hidrógeno, interacciones iónicas, hidrofóbicas y fuerzas de Van der Waals (para refrescar todos estos conceptos visita la entrada: “Enlaces químicos”).
Generalmente, en esta disposición los aminoácidos apolares se sitúan hacia el interior de la proteína y los polares hacia el exterior, interactuando con el ambiente acuoso circundante.
Estructura cuaternaria
En la naturaleza, algunas proteínas se constituyen a partir de varios polipéptidos, conocidos como subunidades y la interacción entre las mismas constituyen la estructura cuaternaria. Se tratan de interacciones débiles que ayudan a estabilizar la estructura global de la proteína.
La disposición cuaternaria, de modo general, otorga el rol de la proteína y mediante ella se forman estructuras de gran importancia biológica como los capsómeros[4] de los virus, los microfilamentos[5], los microtúbulos[6] y las fibrillas de colágeno del tejido conjuntivo.
La disposición cuaternaria, de modo general, otorga el rol de la proteína y mediante ella se forman estructuras de gran importancia biológica como los capsómeros[4] de los virus, los microfilamentos[5], los microtúbulos[6] y las fibrillas de colágeno del tejido conjuntivo.
Desnaturalización y plegamiento
Cada proteína tiene su propia secuencia y forma que la mantiene unida mediante interacciones químicas.
Si la proteína está sujeta a cambios en el pH, en la temperatura o expuesta a químicos, su estructura y forma pueden modificarse sin llegar a verse afectada su secuencia primaria. Este proceso se conoce como desnaturalización, el cual puede ser reversible si la estructura polipeptídica primaria se conserva durante el mismo, manteniendo la proteína su rol.
Cuando el proceso es irreversible, por el contrario, sí que se produce la pérdida de su función. Esto es lo que le ocurre, por ejemplo, a la albúmina (proteína de la clara del huevo), la cual se desnaturaliza de manera irreversible cuando se cocina al someterse a altas temperaturas.
Cuando el proceso es irreversible, por el contrario, sí que se produce la pérdida de su función. Esto es lo que le ocurre, por ejemplo, a la albúmina (proteína de la clara del huevo), la cual se desnaturaliza de manera irreversible cuando se cocina al someterse a altas temperaturas.
El plegamiento de las proteínas juega un papel decisivo en la labor que éstas realizan. Dicho plegamiento se efectúa con la ayuda de las chaperonas que son una familia de proteínas presentes en todas las células y que no forman parte de las proteínas funcionales[7]. Se unen a éstas no sólo para facilitar su plegamiento, sino también para su ensamblaje y transporte celular a otra parte de la célula donde la proteína ejerce su función.
[1] Monómeros de los ácidos nucleicos (DNA y RNA).
[2] Estructura con forma de hoz o media luna.
[3] Enlace covalente fuerte entre grupos tiol (-SH, que contienen azufre) del aminoácido cisteína.
[4] Cubierta exterior de proteína que protege el material genético de un virus.
[5] Fibras finas de proteínas que junto con los microtúbulos le dan soporte a las células.
[6] Estructuras tubulares de las células. Componente principal del citoesqueleto de las células eucariotas.
[7] Aquellas proteínas que poseen función biológica.
[2] Estructura con forma de hoz o media luna.
[3] Enlace covalente fuerte entre grupos tiol (-SH, que contienen azufre) del aminoácido cisteína.
[4] Cubierta exterior de proteína que protege el material genético de un virus.
[5] Fibras finas de proteínas que junto con los microtúbulos le dan soporte a las células.
[6] Estructuras tubulares de las células. Componente principal del citoesqueleto de las células eucariotas.
[7] Aquellas proteínas que poseen función biológica.
Fuentes: OpenStax College, Biology. OpenStax College. 30 May 2013.
http://www.profesorenlinea.cl/Ciencias/ProteinasEstruct.htm
http://study.com/academy/lesson/proteins-iv-higher-order-structure.html
http://quimica.laguia2000.com/conceptos-basicos/cadena-lateral-en-aminoacidos
http://es.slideshare.net/carolinacisdel/biomoleculas-enfermera
http://biologiavfe.blogspot.com.es/2010/04/anemia-falciforme.html
http://sicklecellcurefoundation.org/living-with-sickle-cell-disease/national-sickle-cell-month
http://www.slideshare.net/VijayP7/secondary-structure-prediction-of-proteins
http://www.slideshare.net/thelawofscience/protein-structure-11543259
http://www.mobi4health.ug.edu.pl/wp-content/uploads/2014/10/2ndMSW-Milla-Neffling-Primer.pdf
http://www.profesorenlinea.cl/Ciencias/ProteinasEstruct.htm
http://study.com/academy/lesson/proteins-iv-higher-order-structure.html
http://quimica.laguia2000.com/conceptos-basicos/cadena-lateral-en-aminoacidos
http://es.slideshare.net/carolinacisdel/biomoleculas-enfermera
http://biologiavfe.blogspot.com.es/2010/04/anemia-falciforme.html
http://sicklecellcurefoundation.org/living-with-sickle-cell-disease/national-sickle-cell-month
http://www.slideshare.net/VijayP7/secondary-structure-prediction-of-proteins
http://www.slideshare.net/thelawofscience/protein-structure-11543259
http://www.mobi4health.ug.edu.pl/wp-content/uploads/2014/10/2ndMSW-Milla-Neffling-Primer.pdf








Tu opinión es importante
Estás invitado a enviar cualquier comentario o aportación que quieras realizar, gracias.