En la penúltima entrada (Vías de administración de fármacos) hemos estudiado los diferentes sistemas de administración de fármacos, y en función de nuestros objetivos se seleccionará uno de ellos para así pasar de un compuesto a un producto farmacológico.
En las fases precedentes del desarrollo de medicamentos, los investigadores, a menudo, emplean sistemas vivos para determinar si sus compuestos pueden atravesar las membranas celulares y ejercer su función terapéutica. Pero en muchos fármacos existe un equilibrio muy delicado entre toxicidad y dichos efectos terapéuticos. Para evitar este conflicto se han llevado a cabo, anteriormente, estudios para seleccionar el compuesto líder que presente la menor toxicidad posible junto con la máxima potencia terapéutica.
 Muchas de estas evaluaciones pueden desempeñarse en cultivos celulares en el laboratorio, sin embargo, estos experimentos, en ocasiones, son demasiado simples para predecir la eficacia del compuesto en humanos.
Muchas de estas evaluaciones pueden desempeñarse en cultivos celulares en el laboratorio, sin embargo, estos experimentos, en ocasiones, son demasiado simples para predecir la eficacia del compuesto en humanos.
Por tanto, para ganar un mayor entendimiento de su eficacia y distribución biológica se emplean sistemas vivos más complejos, normalmente ratones o ratas, a los que se les administra una dosis específica para medir sus efectos terapéuticos.
 Muchas de estas evaluaciones pueden desempeñarse en cultivos celulares en el laboratorio, sin embargo, estos experimentos, en ocasiones, son demasiado simples para predecir la eficacia del compuesto en humanos.
Muchas de estas evaluaciones pueden desempeñarse en cultivos celulares en el laboratorio, sin embargo, estos experimentos, en ocasiones, son demasiado simples para predecir la eficacia del compuesto en humanos.Por tanto, para ganar un mayor entendimiento de su eficacia y distribución biológica se emplean sistemas vivos más complejos, normalmente ratones o ratas, a los que se les administra una dosis específica para medir sus efectos terapéuticos.
Los investigadores han encontrado varias maneras de modelar en estos roedores enfermedades humanas tales como el cáncer, ciertas infecciones e inflamaciones.
Si bien estos modelos no son indicadores cien por cien fiables de la efectividad en humanos, son otra herramienta para ayudar a seleccionar el compuesto líder que posea la mayor probabilidad de éxito. Además, estos modelos pueden usarse en estudios para identificar la dosis óptima necesaria del fármaco.
Si bien estos modelos no son indicadores cien por cien fiables de la efectividad en humanos, son otra herramienta para ayudar a seleccionar el compuesto líder que posea la mayor probabilidad de éxito. Además, estos modelos pueden usarse en estudios para identificar la dosis óptima necesaria del fármaco.
A pesar de que, en esta fase la eficacia preclínica no es tan importante como la seguridad, estos estudios sí resultan primordiales para los desarrolladores farmacéuticos a la hora de evaluar cuál es la probabilidad de eficacia del fármaco ante una enfermedad concreta del ser humano.
Una vez el compuesto líder ha sido seleccionado y formulado, se evalúa mediante tests en animales para confirmar que es seguro para su uso en humanos.
Aunque numerosas objeciones éticas surgen a raíz de la experimentación con animales, se trata del mejor método que se ha desarrollado para proteger a los humanos de los riesgos imprevistos que pueden provocar los medicamentos experimentales.
Aunque numerosas objeciones éticas surgen a raíz de la experimentación con animales, se trata del mejor método que se ha desarrollado para proteger a los humanos de los riesgos imprevistos que pueden provocar los medicamentos experimentales.
Con el fin de asegurar la validez y calidad de los datos obtenidos en estas pruebas, se ha establecido un conjunto estricto de regulaciones, denominadas buenas prácticas de laboratorio (GLP), que los desarrolladores deben cumplir. Dichas regulaciones determinan un marco de trabajo organizativo para las nuevas sustancias farmacéuticas, así como la evaluación de cualquier posible toxicidad que pudiera ocurrir durante sus ensayos.
Junto con un conocimiento de los efectos tóxicos potenciales, también es fundamental averiguar durante cuánto tiempo el fármaco se mantiene en la circulación sanguínea, cómo se metaboliza y en qué tejidos podría llegar a acumularse.
Junto con un conocimiento de los efectos tóxicos potenciales, también es fundamental averiguar durante cuánto tiempo el fármaco se mantiene en la circulación sanguínea, cómo se metaboliza y en qué tejidos podría llegar a acumularse.
La etapa preclínica se estima que puede llegar a tener una duración mínima de tres años en la que miles de compuestos no logran alcanzar la siguiente fase. Se considera que de cada 250 compuestos en preclínica, únicamente cinco comienzan el siguiente período de investigación.
En su conjunto las etapas de investigación básica y preclínica engloban un período total de alrededor seis años.
En su conjunto las etapas de investigación básica y preclínica engloban un período total de alrededor seis años.
Si el candidato principal supera los exámenes de seguridad, previamente mencionados, se envía una solicitud a las pertinentes agencias reguladoras como evidencia de que el compuesto es fiable para comenzar los estudios clínicos en humanos. Se debe verificar que el nuevo fármaco no expondrá a los voluntarios durante la primera fase de los ensayos clínicos a un riesgo innecesario para su salud.
De todos modos, en cualquier momento, la investigación puede detenerse si se observa que la integridad del estudio se ve comprometida o el nuevo producto se considera un riesgo para la salud.
Además de estos datos, se debe demostrar que el producto farmacológico se puede fabricar a gran escala mediante un método controlado y reproducible.
De todos modos, en cualquier momento, la investigación puede detenerse si se observa que la integridad del estudio se ve comprometida o el nuevo producto se considera un riesgo para la salud.
Además de estos datos, se debe demostrar que el producto farmacológico se puede fabricar a gran escala mediante un método controlado y reproducible.
Esta etapa en el proceso de desarrollo farmacéutico que, en ocasiones, supone un gran desembolso económico de varios millones de euros para los desarrolladores farmacéuticos, puede suponer un obstáculo insalvable para las pequeñas compañías e investigadores académicos.
Aunque, en un principio, puede parecer excesivo el gasto de tan grandes cantidades de dinero en un nuevo fármaco que todavía no ha sido comercializado, sí es necesario para garantizar, tanto como sea posible, que no causará ningún perjuicio en los primeros humanos sobre los que se evaluará en los ensayos clínicos posteriores.
Aunque, en un principio, puede parecer excesivo el gasto de tan grandes cantidades de dinero en un nuevo fármaco que todavía no ha sido comercializado, sí es necesario para garantizar, tanto como sea posible, que no causará ningún perjuicio en los primeros humanos sobre los que se evaluará en los ensayos clínicos posteriores.
En España es la AEMPS (Agencia Española de Medicamentos y Productos Sanitarios), agencia estatal adscrita al Ministerio de Sanidad, la que garantiza a los ciudadanos y profesionales sanitarios la seguridad, eficacia, calidad y correcta información de los medicamentos y productos sanitarios que se comercializan en España, desde su experimentación hasta su empleo.
Fuentes: UTAustinX: UT.4.01x Take Your Medicine - The Impact of Drug Development.
https://www.msdsalud.es/tu-salud-al-dia/biblioteca-recursos/guias-para-pacientes/proceso-investigacion-desarrollo-aprobacion-
farmaco.html
http://geneticayclonacion.blogspot.com.es/2015_04_01_archive.html
http://www.aemps.gob.es/laAEMPS/estructura/home.htm
http://www.abc.es/sociedad/20150518/abci-investigacion-animales-laboratorio-201505161636.html
https://www.msdsalud.es/tu-salud-al-dia/biblioteca-recursos/guias-para-pacientes/proceso-investigacion-desarrollo-aprobacion-
farmaco.html
http://geneticayclonacion.blogspot.com.es/2015_04_01_archive.html
http://www.aemps.gob.es/laAEMPS/estructura/home.htm
http://www.abc.es/sociedad/20150518/abci-investigacion-animales-laboratorio-201505161636.html


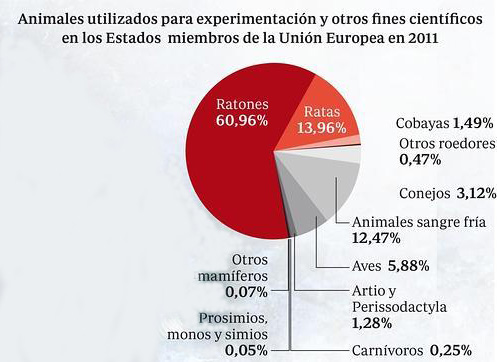




Tu opinión es importante
Estás invitado a enviar cualquier comentario o aportación que quieras realizar, gracias.